La configuración electrónica de un elemento es una representación del orden de los electrones al rededor del núcleo atómico, cada uno de los términos en una configuración electrónica se puede ver como en la Imagen 02 (igual a como se ordenaban los números cuánticos, porque tienen todo que ver).
Así cada término de la configuración electrónica nos dirá el nivel de energía y el subnivel de cada electrón en un átomo y la cantidad de electrones que hay en el subnivel especificado.
Los elementos con configuración electrónica más simple son aquellos que tienen menor Z, ya que en átomos neutros Z = #electrones, por lo tanto, menos términos requerirá para construirla.
A continuación, se presentan tres lineamientos necesarios para formar y evaluar una configuración electrónica de forma correcta.
Principio de Aufbau
Recordemos:
- La energía de los orbitales atómicos depende del número cuántico principál n, cuanto mayor sea el valor de n, mayor será la energía de los electrones en ese nivel.
- La repulsión entre los electrones ubicados al interior de los subniveles, dan como resultado una diferenciación de la energía; de esta forma diferentes valores para l representan diferencias de energía al interior de un nivel de energía. Los subniveles se ordenaran entonces por la cantidad de energía que poseen, así: s < p < d < f .
En el esquema de la Imagen 03 se observa la clasificación energética de los niveles de energía y de los subniveles de energía. El nivel 1 es el que posee menor cantidad de energía y al tiempo es el más cercano al núcleo, de allí aparencen otros niveles y subniveles de nergía, hasta llegar al nivel 7 (donde observamos traslapes de niveles y subniveles) de mayor energía y el más lejano del núcleo.
 Imagen 03. Diagrama de moeller, generalizado para el nivel y los orbitales atómicos en un átomo con dos o más electrones (no a escala).
Imagen 03. Diagrama de moeller, generalizado para el nivel y los orbitales atómicos en un átomo con dos o más electrones (no a escala).
La información descrita y la Imagen 03, se conoce como el principio de aufbau (no hace referencia al apellido de un cuentífico, sino a la palabra construcción en alemán "Aufbeen") y determina el orden en el que los electrones se ubican en la periferia del átomo, ocupando primero los niveles y subniveles atómicos de menor energía, una vez estos están llenos, los siguientes electrones ocuparán niveles y subniveles de mayor energía; este proceso es semejante a la construcción del edificio, donde las obras inician por la bases en la parte baja y se procede de forma vertical hasta llegar al techo.
Ejemplo 01:
Comparando los subniveles descritos con 1s , 2s , 2p, ¿cuál será el orden en el que los electrones se ubiquen entre estos subniveles?
Análisis:
Observando la descripción presentada anteriormente y teninedo de apoyo la Imagen 03, la menor energía la posee el orbital 1s, seguido por el orbital 2s y por último el orbital 2p, así mismo están ordenados de primer a tercer lugar respectivamente.
Conclusión:
Los electrones se ubicarán primero en el subnivel 1s, posteriormente en el subnivel 2s y por último en el subnivel 2p.
Ejemplo 02:
Comparando los subniveles 4d, 4f, 5s, 5p, 6s, ¿cuál será el orden en el que los electrones se ubiquen entre estos subniveles?
Análisis:
La intuición nos puede llevar a pensar que ya están ordenados, pero debemos observar el diagrama de la Imagen 03 para estar seguros de eso.
Observando la Imagen 03, observamos que por cantidad de energía el orden es diferente, ya que como se mencionó antes, en los niveles altos, existen traslapes de niveles y subniveles; así de menor a mayor nivel de energía tendríamos el siguiente orden: 5s - 4d - 5p - 6s - 4f.
Conclusión:
Los electrones se ubicarán de forma consecutiva y como se mostró en el análisis iniciando en el subnivel 5s, luego en 4d, 5p, 6s y por último en el subnivel 4f.
Este fenómeno es posible debido a que los orbitales tipo f, tienen alto nivel energético, gran capacidad para albergar electrones, lo que los posiciona por encima de orbitales en niveles superiores, por ejemplo 5s, 5p y 6s.
Ejemplo 03:
Identificar los números cuánticos n, l, y la cantidad electrones ubicados en el orbital descrito por el término 3p4.
Análisis:
Según lo descrito en la Imagen 01 tenemos:
3p4
*** El primer número cuántico, n , es igual al coeficiente del término.
*** El segundo número cuántico, l ,es igual al valor numérico correspondiente al tipo de orbital.
*** La cantidad de electrones que se encuentran en el orbital especificado en el término, se identifica por el número que aparece como super índice del tipo de orbital.
Conclusión:
Los números cuánticos y la cantidad de electrones se enlista a continuación:
n = 3 (nivel de energía)
l = 1 (el tipo de orbital "p" se expresa de forma numérica como 1)
#electrones = 4 electrones
En el link encontrarán otra forma del diagrama de construcción electrónica.
Principio de Exclusión de Pauli
Recordemos:
- Los subniveles de energía poseen una o más regiones específicas llamadas orbitales.
- Cada orbital puede albergar máximo dos electrones.
- La relación entre subniveles, cantidad de orbitales y electrones, se muestra a continuación
Subnivel tipo s, cuenta con 1 orbital y puede contener máximo 2 e-.
Subnivel tipo p, cuenta con 3 orbitales y puede contener máximo 6 e-.
Subnivel tipo d, cuenta con 5 orbitales y puede contener máximo 10 e-.
Subnivel tipo f, cuenta con 7 orbitales y puede contener máximo 14 e-.
- Los diagramas de orbitales son representaciones de la disposición de los electrones en un átomo, permite identificar su nivel, subnivel, orbital y espín como se presenta a continuación.
En la Imagen 04 se observa una modificación al diagrama de moeller, este diagrama presenta la cantidad de orbitales (círculos sobre cada franja) presentes en cada uno de los subniveles, a esta representación se le conoce como diagrama de orbitales.
 Imagen 04. Diagrama generalizado de nivel de energía para orbitales atómicos en un átomo con dos o más electrones (no a escala).
Imagen 04. Diagrama generalizado de nivel de energía para orbitales atómicos en un átomo con dos o más electrones (no a escala).
El principio de Exclusión de Pauli se enfoca en limitar la cantidad y la forma en la que los electrones se ubican en un mismo orbital. Así señala que en cada uno de los orbitales pueden haber máximo dos electrones, cada uno de los cuales debe contener el número cuántico espín (ms) contrario (+1/2 o -1/2). En otras palabras, no habrá dos electrones en el mismo átomo que puedan ser descritos con los mismos cuatro números cuánticos.
Los electrones se representarán en el diagrama de orbitales como flechas, apuntando hacia arriba ↑ si el espín es positivo (+1/2) o una flecha apuntando hacia abajo ↓ si el espín es negativo (-1/2).
Ejemplo 01:
Analice los electrones del Helio cuyo número atómico (Z) es 2.
Análisis:
Conociendo el número atómico del He sabemos que cuenta con 2e- (#e- = Z, en átomos neutros)
Según el diagrama de moeller, ambos electrones se ubican en el orbital 1s, que se representan en la Imagen 05.

Imagen 05. Orbital 1s.
Debido a esto comparten los primeros tres números cuánticos, así:
Ambos electrones están en el mismo
Nivel, n : 1
Subnivel, l : 0 (o sea tipo s)
Orbital, ml : 0
Aquí es donde el número cuántico espín (ms) se utiliza para diferenciar a cada uno de los electrones al interior de un orbital, comos e muestra a continuación:
El primer electrón de He tendrá ms= +1/2 (espín positivo).
El segundo electrón de He tendrá ms= -1/2 (espín negativo).
Conclusión:
Cumpliendo con el Principio de Aufbau y el Principio de Exclusión de Pauli tenemos que ambos electrones de He se encuentran en el mismo nivel de energía (n), en el mismo subnivel (l) y orbital (ml), y ya que cada electrón es único, se diferencian ya que cada uno presenta un número spin (ms) diferente, +1/2 para el primer electrón y -1/2 para el segundo electrón.
Basados en la Imagen 06, el término que describiría la configuración electrónica del He es 1s2.
 Imagen 06. Orbital 1s lleno, spin de cada electrón.
Imagen 06. Orbital 1s lleno, spin de cada electrón.
El ejemplo anterior se puede generalizar para todas las parejas de electrones ubicados en los diferentes orbitales.
Regla de Hund
Recordemos:
- Los orbitales son regiones específicas de energía en las que se dividen los diferentes tipos de subniveles (s , p , d , f).
- Los orbitales del mismo tipo ubicados en el mismo nivel de energía son energéticamente iguales entre ellos.
- Los orbitales de diferentes tipos ubicados en el mismo nivel de energía son energéticamente diferentes (s < p < d < f), aun estando en el mismo nivel de energía.
- Cada orbital puede albergar máximo dos electrones.
- Cada electrón en un átomo contará con una combinación exclusiva de valores para los números cuánticos (n, l, ml, ms).
En la animación de la Imagen 07 se observa la forma en la que se ordenan los electrones en los átomos de los primeros 20 elementos, iniciando en el elemento hidrógeno (H) y terminando en el elemento calcio (Ca).
Se puede observar cómo los electrones siguen un orden determinado al ir ocupando los espacios disponibles en el diagrama de orbitales.
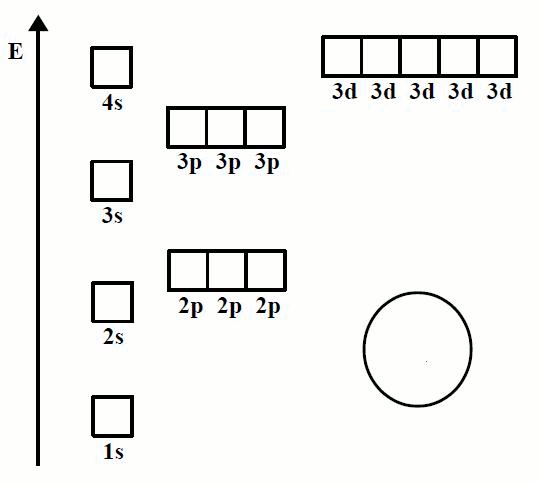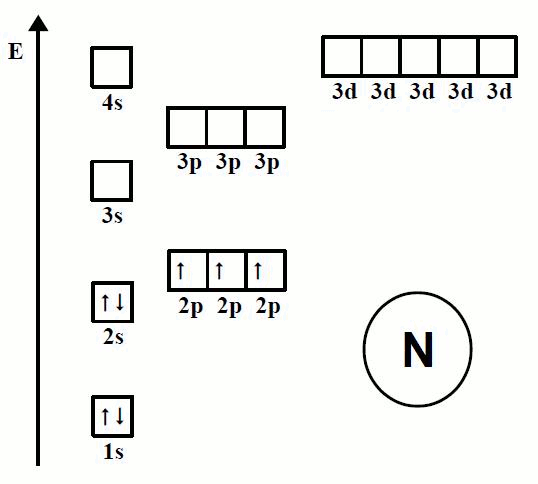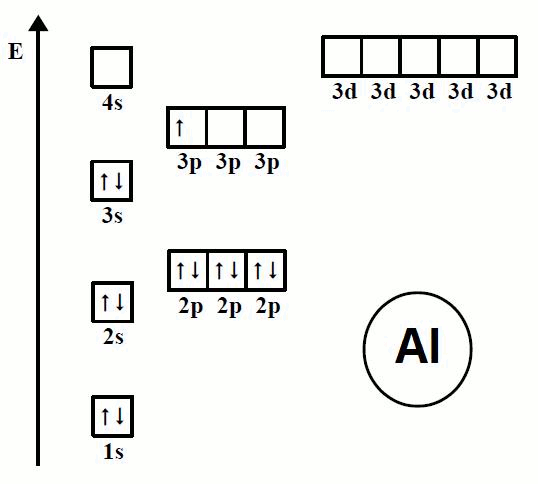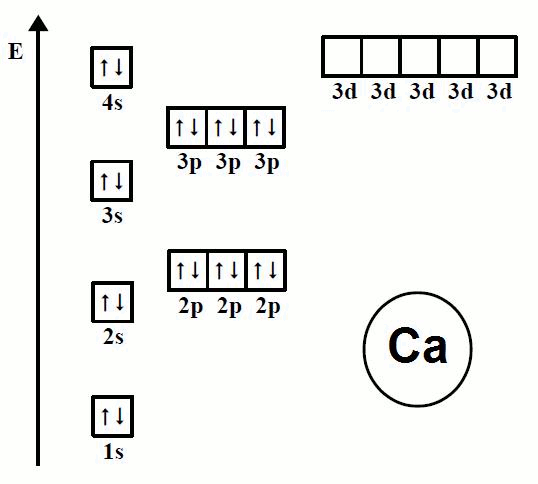
Imagen 07. Orden de llenado de los orbitales, Regla de Hund.
Observemos que...
- En los orbitales tipo s mostrados en la animación se disponen máximo dos electrones (representados como flechas), los cuales se ordenan ubicando primero el eletrón con espín positivo (↑) y luego el electrón con espín negativo (↓). Así se logra emparejar los electrones y estabilizar los orbitales tipo s en cualquier nivel de energía.
- En cuanto a los orbitales tipo p los electrones se ubican como se describe a continuación.
- Los primeros tres electrones se disponen con espín positivo ocupando cada orbital tipo p disponible de izquierda a derecha en el diagrama. Buscando estabilizar la región de energía.
- Los otros tres electrones se dispondrán con espín negativo, ubicándose al lado de los electrones de espín positivo, siguiendo el orden de izquierda a derecha en el diagrama hasta completar dos electrones en cada orbital. Logrando así emparejarán los electrones en los orbitales tipo p, aplica en cualquier nivel de energía.
- El proceso descrito anteriormente se cumple para orbitales tipo d, f y cualquier otro tipo que cuente con más de un orbital.
Lo descrito se realiza para cumplir con la regla de Hund, la cual indica que En orbitales del mismo tipo (l) ubicados a la vez en el mismo nivel de energía (n), los electrones se ubicaran inicialmente de forma tal que en cada uno de los orbitales disponibles haya un electrón de espín positivo, posteriormente se ubicarán los electrones con espín negativo, logrando el emparejamiento electrónico.
Lo descrito anteriormente se podrá practicar en el simulador que se encuentra en la
actividad 3_01.
Ejemplo 01:
En un diagrama de orbitales muestre la ubicación de los electrones para el átomo de carbono neutro (Z=6), siguiendo las reglas estudiadas hasta este momento.
Análisis:
Sabiendo que el número atómico del carbono es Z=6, definimos que cuenta con 6 electrones dado que está neutro.
Según el principio de aufbau y el principio de exclusión de Pauli, los electrones del carbono se distribuirán de la siguiente forma:
- En el primer nivel de energía se encuentra el orbital 1s y éste podrá contener máximo dos electrones.
- En el segundo nivel de energía se encuentran los orbitales 2s y 2p, los electrones se ubicarán siguiendo el orden de menor a mayor energía (diagrama de moeller), por lo que primero se llena el orbital 2s con dos electrones, y luego los dos electrones restantes se disponen en los orbitales 2p.
- Los orbitales 2p no se llenan ya que en ellos solo se van a ubicar dos de los seis electrones que puede contener.
Siguiendo la regla de Hund los electrones a ubicar en los orbitales 2p deben ubicarse con espín positivo en dos de los tres orbitales disponibles.
Conclusión:
Se presenta en la imagen 08.a) la forma correcta de ubicar los electrones del carbono en el diagrama de orbitales y imagen 08.b) muestra un error que se podría llegar a cometer si no se sigue la regla de Hund.

Imagen 08. Diagrama de orbitales con la distribución de los electrones para el elemento carbono. a) forma correcta. b) forma incorrecta.
Siguiendo los lineamientos vistos anteriormente se puede predecir la configuración electrónica de cualquier elemento químico, siempre y cuando conozcamos el número de electrones o protones que contiene.
Ejemplo 01. Diagramas de orbitales y configuraciones electrónicas
Escriba la configuración electrónica para el fluor y el cloro utilizando el diagrama el diagrama de construcción electrónica.
Paso a Paso:
1. Utilizando la tabla periódica se reconocre el número atómico del fluor (F) y del cloro (Cl).
Número atómico del fluor, Z = 9
Número atómico del cloro, Z = 17
2. Conociendo que el número atómico y el número de electrones es igual para átomos neutros como los referenciados en el ejercicio, definimos que los electrones de cada elemento es
Número de electrones del fluor= 9e-
Número de electrones del cloro = 17e-
3. Utilizando el diagrama de construcción electrónica se inicia ubicando la cantidad de electrones posible en cada uno de los orbitales, hasta agotar los disponibles de cada elemento.
|
Fluor, 9e-
1s2 2s2 2p5
|
Los superíndices coloreados en rojo, muestran la cantidad de electrones que se ubican en cada nivel y orbital.
La suma de los super índices debe ser igual a la cantidad de los electrónes del átomo
2e- + 2e- + 5e- = 9e-
Los electrones se ordenan así:
2e- en 1s, 2e- en 2s y 5e- en 2p
En cada uno de los orbitales se ubicarán electrones sin superar el número de electrones posibles.
|
|
Cloro, 17e-
1s2 2s2 2p6 3s2 3p5
|
Los superíndices coloreados en rojo, muestran la cantidad de electrones que se ubican en cada nivel y orbital.
La suma de los super índices debe ser igual a la cantidad de los electrónes del átomo
2e- + 2e- + 6e- + 2e- + 5e- = 17e-
Los electrones se ordenan así:
2e- en 1s, 2e- en 2s, 6e- en 2p, 2e- en 3s, 5e- en 3p
En cada uno de los orbitales se ubicarán electrones sin superar el número de electrones posibles.
|
Ejemplo 02. Diagramas de orbitales y configuraciones electrónicas
Dibuje el diagrama de orbitales para el oxígeno y escriba su configuración electrónica.
Análisis:
Utilizando la tabla periódica se conocerá el número atómico del oxígeno.
Número atómico del oxígeno, Z = 8
Aplicando los lineamientos para la distribución de los electrones definimos la cantidad de electrones en cada orbital (similar al ejemplo con el carbono)
Según el principio de aufbau y el principio de exclusión de Pauli, los electrones del oxígeno se distribuirán de la siguiente forma:
- En 1s ubicaremos los dos primeros electrones.
- En 2s ubicaremos otros dos electrones.
- En 2p ubicaremos los cuatro electrones restantes, siguiendo el orden adecuado.
- Los orbitales 2p no se llenan ya que en ellos solo se van a ubicar cuatro de los seis electrones que puede contener.
Siguiendo la regla de Hund los electrones a ubicar en los orbitales 2p deben ubicarse así:
1. Ubicar los primeros tres electrones con espín positivo en cada uno de los disponibles.
2. Ubicar el electrón extra con espín negativo en el primer orbital, emparejando uno de los electrones de espín positivo.
Conclusión:
La configuración electrónica está determinada por el análisis que se realiza sobre la distribución de los electrones en los orbitales y niveles de energía (también es posible realizarla siguiendo el diagrama de construcción electrónica), por lo que se obtiene para el oxígeno la configuración electrónica: 1s2 2s2 2p4
El diagrama de orbitales con la distribución de electrones se presenta a continuación.
 Imagen 09. Diagrama de orbitales con la distribución de los electrones para el elemento oxígeno.
Imagen 09. Diagrama de orbitales con la distribución de los electrones para el elemento oxígeno.
El siguiente video los guiará en la práctica de la configuración electrónica y los lineamientos de ordenamiento de los electrones en los diagramas de orbitales, así como presentará la regla de Kernel o también conocida como Configuración Electrónica Abreviada.





 Imagen 06. Orbital 1s lleno, spin de cada electrón.
Imagen 06. Orbital 1s lleno, spin de cada electrón.

